ong noi loc
New member
- Xu
- 26
BÀI 35 BENZEN VÀ ĐỒNG ĐẲNG , MỘT SỐ HRCB THƠM KHÁC.
PHẦN I BENZEN VÀ ĐỒNG ĐẲNG.
I- CẤU TRÚC, ĐỒNG ĐẲNG, ĐỒNG PHÂN VÀ DANH PHÁP
1. Cấu trúc của phân tử benzen
a) Sự hình thành liên kết trong phân tử benzen

Sáu nguyên tử C trong phân tử benzen ở trạng thái lai hóa sp2 (lai hóa tam giác).
Mỗi nguyên tử C sử dụng 3 obitan lai hóa để tạo liên kết σ với 2 nguyên tử C bên cạnh nó và 1 nguyên tử H. Sáu obitan p còn lại của 6 nguyên tử C xen phủ bên với nhau tạo thành hệ liên hợp π chung cho cả vòng benzen. Nhờ vậy mà liên kết π ở benzen tương đối bền vững hơn so với liên kết π ở anken cũng như hiđrocacbon không no khác.
b) Mô hình phân tử
Sáu nguyên tử C trong phân tử benzen tạo thành một lục giác đều. Cả 6 nguyên tử C và 6 nguyên tử H cùng nằm trên một mặt phẳng (gọi là mặt phẳng phân tử). Các góc liên kết đều bằng 120[SUP]o[/SUP]

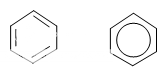
c) Biểu diễn cấu tạo của benzen
Hai kiểu công thức bên đều được dùng để biểu diễn cấu tạo của benzen. Chỉ khi cần thiết mới phải ghi rõ các nguyên tử H.
2. Đồng đẳng, đông phân và danh pháp
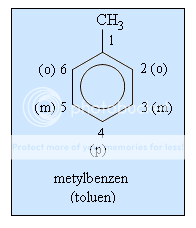
Khi thay các nguyên tử hiđro trong phân tử benzen (C6H6) bằng các nhóm ankyl, ta được các ankylbenzen. Thí dụ:
C6H5−CH3 C6H5−CH2−CH3 C6H5−CH2−CH2−CH3...
metylbenzen (toluen) etylbenzen propylbenzen ...
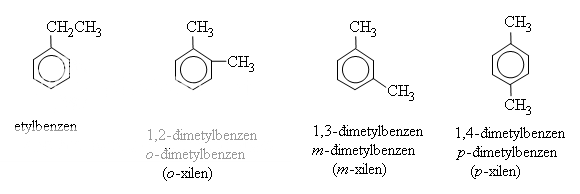
Các ankylbenzen họp thành dãy đồng đẳng của benzen có công thức chung là CnH2n−6 với n≥ 6
Khi coi vòng benzen là mạch chính thì các nhóm ankyl đính với nó là mạch nhánh (còn gọi là nhóm thế).
Ankylbenzen có đồng phân mạch cacbon. Để gọi tên chúng, phải chỉ rõ vị trí các nguyên tử C của vòng bằng các chữ số hoặc các chữ cái o,m,p (đọc là ortho, meta, para) như hình bên.
II- TÍNH CHẤT VẬT LÍ
1. Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng
2. Màu sắc, tính tan và mùi
Benzen và ankylbenzen là những chất không màu, hầu như không tan trong nước nhưng tan nhiều trong dung môi hữu cơ, đồng thời chính chúng cũng là dung môi hòa tan nhiều chất khác. Chẳng hạn benzen hòa tan brom, iot, lưu huỳnh, cao su, chất béo,... Các aren đều là những chất có mùi. Chẳng hạn như benzen và toluen có mùi thơm nhẹ, nhưng có hại cho sức khỏe, nhất là benzen.
III- TÍNH CHẤT HÓA HỌC
1. Phản ứng thế
a) Phản ứng halogen hóa
* Khi có bột sắt, benzen tác dụng với brom khan tạo thành brombenzen và khí hiđro bromua.
Toluen phản ứng nhanh hơn benzen và tạo ra hỗn hợp hai đồng phân ortho và para.
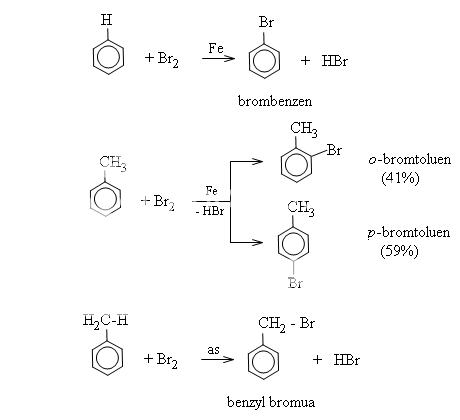
Nhóm C6H5CH2 gọi là nhóm benzyl, nhóm C6H5 gọi là nhóm phenyl.
b) Phản ứng nitro hóa

* Benzen tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc tạo thành nitrobenzen:
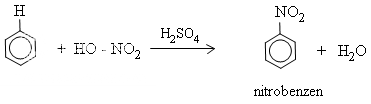
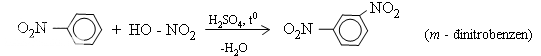
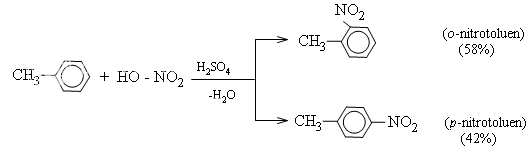
Khi ở vòng benzen đã có sẵn nhóm ankyl (hay các nhóm −OH,−NH2,−OCH[SUB]3[/SUB],...), phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí ortho và para. Ngược lại, nếu ở vòng benzen đã có sẵn nhóm −NO[SUB]2[/SUB] (hoặc các nhóm −COOH, −SO[SUB]3[/SUB]H,...) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
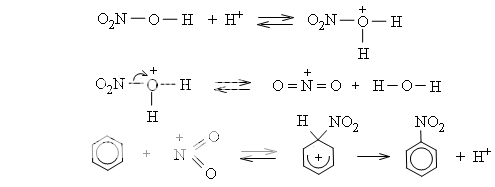
d) Cơ chế phản ứng thế ở vòng benzen
Phân tử halogen hoặc phân tử axit nitric không trực tiếp tấn công. Các tiểu phân mang điện tích dương tạo thành do tác dụng của chúng với xúc tác mới là tác nhân tấn công trực tiếp vào vòng benzen. Thí dụ:
2. Phản ứng cộng
* Benzen và ankylbenzen không làm mất màu dung dịch brom (không cộng với brom) như các hiđrocacbon không no. Khi chiếu sáng, benzen cộng với clo thành C6H6Cl6
* Khi đun nóng có xúc tác Ni hoặc Pt, benzen và ankylbenzen cộng với hiđro thành xicloankan, thí dụ:
C6H6 + 3H2 → C6H12
3. Phản ứng oxi hóa
* Benzen không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4).
* Các ankylbenzen khi đun nóng với dung dịch KMnO4 thì chỉ có nhóm ankyl bị oxi hóa. Thí dụ: Toluen bị KMnO4 oxi hóa thành kali benzoat, sau đó tiếp tục cho tác dụng với axit benzoic.
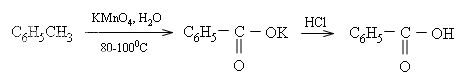
C6H6 + 15/2 O2 → 6CO2 + 3H2O ; ΔH = − 3273kJ
Nhận xét: benzen tương đối dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền vững với các chất oxi hóa. Đó cũng là tính chất hóa học đặc trưng chung của các hiđrocacbon thơm nên được gọi là tính thơm.
IV- ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
Benzen, toluen, xilen,... thường tách được bằng cách chưng cất dầu mỏ và nhựa than đá. Chúng còn được điều chế từ ankan, hoặc xicloankan:
CH3[CH2]4CH3 → C6H6 + 4H2
CH3[CH2]5CH3 → C6H5CH3 + 4H2
Etylbenzen được điều chế từ benzen và etilen:CH3[CH2]5CH3 → C6H5CH3 + 4H2
C6H6 + CH2=CH2 → C6H5CH2CH3
2. Ứng dụng
Benzen là một trong những nguyên liệu quan trọng nhất của công nghiệp hóa hữu cơ. Nó được dùng nhiều chất để tổng hợp các monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi (chẳng hạn polistiren, cao su buna-stiren, tơ capron). Từ benzen người ta điều chế ra nitrobenzen, anilin, phenol dùng để tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại,...
Toluen được dùng để sản xuất thuốc nổ TNT (trinitrotoluen)
Benzen, toluen và các xilen còn được dùng nhiều làm dung môi.
Sửa lần cuối bởi điều hành viên:
