ong noi loc
New member
- Xu
- 26
BÀI SỰ BIẾN ĐỔI TÍNH KIM LOẠI , TÍNH PHI KIM CỦA CÁC NGUYÊN TỐ HÓA HỌC.
PHẦN II
PHẦN II
II - SỰ BIẾN ĐỔI VỀ HÓA TRỊ CỦA CÁC NGUYÊN TỐ
Trong một chu kì, đi từ trái sang phải, hóa trị cao nhất của các nguyên tố với oxi tăng lần lượt từ 1 đến 7, còn hoá trị với hiđro của các phi kim giảm từ 4 đến 1.
Thí dụ: Trong chu kì 3, ba nguyên tố đầu chu kì (Na, Mg, Al) tạo thành hợp chất oxit trong đó các nguyên tố có hóa trị lần lượt là 1, 2, 3. Các nguyên tố tiếp theo (Si, P, S, Cl) có hóa trị lần lượt là 4, 5, 6, 7 trong oxit cao nhất.
Các nguyên tố phi kim Si, P, S, Cl tạo được hợp chất khí với hiđro, trong đó chúng có hóa trị lần lượt là 4, 3, 2,1.
Đối với các chu kì khác, sự biến đổi hóa trị của các nguyên tố cũng diễn ra tương tự (bảng 2.4)
Bảng 2.4
Sự biến đổi tuần hoàn hóa trị của các nguyên tố ở chu kì 2 và 3
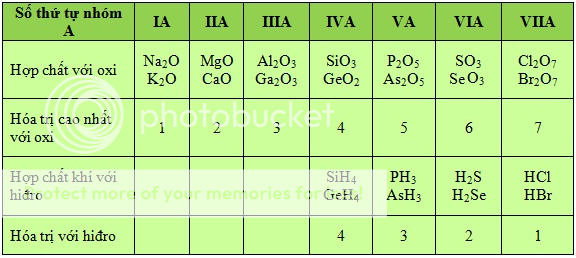
Nhận xét: Hóa trị cao nhất của một nguyên tố với oxi, hóa trị với hiđro của các phi kim biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
III - SỰ BIẾN ĐỔI TÍNH AXIT - BAZƠ CỦA OXIT VÀ HIĐROXIT TƯƠNG ỨNG
Tính axit - bazơ của oxit và hiđroxit tương ứng của các nguyên tố ở chu kì 2 và 3 được trình bày trong bảng 2.5.
Bảng 2.5
Tính axit - bazơ của oxit và hiđroxit tương ứng của các nguyên tố ở chu kì 2 và 3
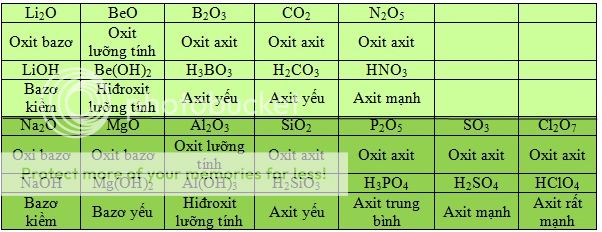
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng tăng dần, đồng thời tính axit của chúng giảm dần.
Nhận xét: Tính axit - bazơ của các oxit và hiđroxit tương ứng của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
IV - ĐỊNH LUẬT TUẦN HOÀN
Định luật tuần hoàn được phát biểu như sau:
"Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử."
Sửa lần cuối bởi điều hành viên:
