ong noi loc
New member
- Xu
- 26
BÀI NĂNG LƯỢNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ VÀ CẤU HÌNH ELECTRON
PHẦN I.
I- NĂNG LƯỢNG CỦA ELECTRON TRONG NGUYÊN TỬ
1- Mức năng lượng obitan nguyên tử
Trong nguyên tử, các electron trên mỗi obitan có một mức năng lượng xác định. Người ta gọi mức năng lượng này là mức năng lượng obitan nguyên tử (mức năng lượng AO)
Các electron trên các obitan khác nhau của cùng một phân lớp có năng lượng như nhau. Thí dụ : Ứng với n=2, ta có 2 phân lớp là 2s và 2p. Phân lớp 2s chỉ có một obitan 2s, còn phân lớp 2p có 3 obitan : 2px,2py,2pz. Các electron của các obitan p trong phân lớp này tuy có sự định hướng trong không gian khác nhau, nhưng chúng có cùng mức năng lượng AO.

2. Trật tự các mức năng lượng obitan nguyên tử
Thực nghiệm và lí thuyết cho thấy khi số hiệu nguyên tử Z tăng, các mức năng lượng AO tăng dần theo trình tự sau :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d....
Từ trình tự mức năng lượng AO trên cho thấy khi điện tích hạt nhân tăng có sự chèn mức năng lượng, mức 4s trở nên thấp hơn 3d, mức 5s thấp hơn 4d,6s thấp hơn 4f,5d,...II- CÁC NGUYÊN LÍ VÀ QUY TẮC PHÂN BỐ ELECTRON TRONG NGUYÊN TỬ
Sự phân bố các electron trong nguyên tử tuân theo nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun (F.Hund).
1. Nguyên lí Pau-li
a) Ô lượng tử
Để biểu diễn obitan nguyên tử một cách đơn giản, người ta còn dùng ô vuông nhỏ, được gọi là ô lượng tử. Một ô lượng tử ứng với một AO. Thí dụ : Ứng với n=1 chỉ có một onitan 1s, ta vẽ một ô vuông. Ứng với n=2 có một obitan 2s và ba obitan 2p(2px,2py,2pz), ta vẽ một ô vuông thuộc phân lớp 2s và ba ô vuông này được vẽ liền nhau, để chỉ rằng các obitan 2p có cùng mức năng lượng AO, nhưng cao hơn AO−2s như hình vẽ sau :
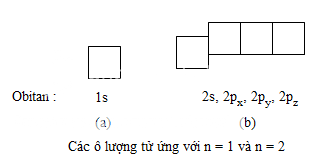
b) Nguyên lí Pau-li
Trên một obitan chỉ có thể có nhiều nhất là hai electron và hai electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron. Người ta biểu thị chiều tự quay khác nhau quanh trục riêng của hai electron bằng 2 mũi tên nhỏ : Một mũi tên có chiều đi lên, một mũi tên có chiều đi xuống. Trong một obitan đã có 2 electron, thì 2 electron đó gọi là electron ghép đôi. Khi obitan chỉ có một electron thì electron đó gọi là electron độc thân.

c) Số electron tối đa trong một lớp và trong một phân lớp
- Số electron tối đa trong một lớp electron : Ta đã biết lớp n2 obitan. Mỗi obitan theo nguyên lí Pau-li có tối đa 2 electron. Do đó : Lớp n có tối đa 2 n2 electron.
- Số electron tối đa trong một phân lớp electron. Cũng theo nguyên lí Pau-li, ta có thể biết được số electron tối đa trong một phân lớp. Phân lớp s chỉ có một obitan, vậy chỉ có tối đa 2 electron. Phân lớp p có 3 obitan nên có tối đa 6 electron, tương tự phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron. Ta có thể biểu diễn số electron tối đa trong các phân lớp bằng các ô lượng tử như hình vẽ dưới
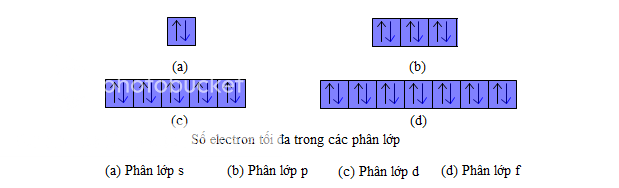
Các phân lớp : s2,p6,d10,f14 có đủ số electron tối đa gọi là phân lớp bão hoà. Còn phân lớp chưa đủ số electron tối đa gọi phân lớp chưa bão hoà. Thí dụ các phân lớp s1,p3,d7,f12....
Sửa lần cuối bởi điều hành viên:
