ong noi loc
New member
- Xu
- 26
BÀI LIÊN KẾT CỘNG HÓA TRỊ
PHẦN I
PHẦN I
I - SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ BẰNG CẶP ELECTRON CHUNG
1. Sự hình thành phân tử đơn chất
a) Sự hình thành phân tử H[SUB]2[/SUB]
Nguyên tử H (Z=1) có cấu hình electron là 1s1, hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử H2. Như thế trong phân tử H2, mỗi phân tử có 2 electron, giống cấu hình electron bền vững của khí hiếm heli:
H[SUP].[/SUP] + [SUP].[/SUP]H → H : H
b) Sự hình thành phân tử N2
Cấu hình electron nguyên tử của N (Z=7) là 1s[SUP]2[/SUP]2s[SUP]2[/SUP]2p3, có 5 electron ở lớp ngoài cùng.
Trong phân tử nitơ N2, để đạt cấu hình electron của nguyên tử khí hiếm gần nhất (Ne), mỗi nguyên tử nitơ phải góp chung 3 electron.

Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
Các phân tử H2, N2 tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ âm điện như nhau), nên các cặp electron chung không bị hút lệch về phía nguyên tử nào. Do đó, liên kết trong các phân tử đó không bị phân cực. Đó là liên kết cộng hóa trị không cực.
2. Sự hình thành phân tử hợp chất
a) Sự hình thành phân tử HCl
Trong phân tử hiđro clorua, mỗi nguyên tử (H và Cl) góp 1 electron tạo thành 1 cặp electron chung để tạo nên một liên kết cộng hóa trị. Độ âm điện của clo là 3,16 lớn hơn độ âm điện của hiđro là 2,20 nên cặp electron liên kết bị lệch về phía clo, liên kết cộng hóa trị này bị phân cực.
Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía kí hiệu của
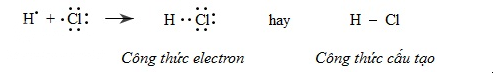
H : Cl
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.b) Sự hình thành phân tử CO2 (có cấu tạo thẳng)
Cấu hình electron nguyên tử của C (Z=6) là 1s[SUP]2[/SUP]2s[SUP]2[/SUP]2p[SUP]2[/SUP], nguyên tử cacbon có 4 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử của O (Z=8) là 1s[SUP]2[/SUP]2s[SUP]2[/SUP]2p[SUP]4[/SUP], nguyên tử oxi có 6 electron ở lớp ngoài cùng.
Trong phân tử CO[SUB]2[/SUB], nguyên tử C nằm giữa 2 nguyên tử O và góp chung với mỗi nguyên tử O hai electron, mỗi nguyên tử O góp chúng với nguyên tử C hai electron tạo ra 2 liên kết đôi.
Ta có:

Sửa lần cuối bởi điều hành viên:
