ong noi loc
New member
- Xu
- 26
BÀI KHÁI NIỆM VỀ LIÊN KẾT HÓA HỌC , LIÊN KẾT ION
PHẦN II
PHẦN II

II. LIÊN KẾT ION
2. Sự hình thành liên kết ion
a) Sự tạo thành liên kết ion của phân tử 2 nguyên tử
Xét sự hình thành liên kết ion trong phân tử natri clorua (NaCl) .
Do đặc điểm cấu tạo nguyên tử và theo quy tắc bát tử, khi các nguyên tử Na và Cl tiếp xúc với nhau sẽ có sự nhường và nhân electron để trở thành các ion Na+ và Cl−, có cấu hình electron nguyên tử giống cấu hình electron nguyên tử của các khí hiếm Ne và Ar. Các ion Na+ và Cl− được tạo thành có điện tích trái dấu, hút nhau tạo nên liên kết ion trong phân tử cũng như trong tinh thể NaCl.
Sự hình thành liên kết ion trong phân tử NaCl có thể tóm tắt bằng sơ đồ sau:
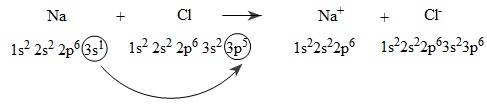
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na[SUP]+[/SUP] + Cl[SUP]−[/SUP] → NaCl
b) Sự tạo thành liên kết ion trong phân tử nhiều nguyên tử
Thí dụ: Phân tử CaCl2.
Tương tự như sự hình thành phân tử NaCl, sự hình thành liên kết ion trong phân tử CaCl2 có thể biểu diễn bằng sơ đồ sau:
Các ion Ca[SUP]2+[/SUP] và Cl− tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử CaCl[SUB]2[/SUB]:
Ca[SUP]2+[/SUP] + 2Cl[SUP]−[/SUP] → CaCl[SUB]2[/SUB]
Vậy: Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình.
III - TINH THỂ VÀ MẠNG TINH THỂ ION
1. Khái niệm về mạng tinh thể
Tinh thể được cấu tạo từ những nguyên tử, hoặc ion, hoặc phân tử. Các hạt này được sắp xếp một cách đều đặn, tuần hoàn theo một trật tự nhất định trong không gian tạo thành mạng tinh thể. Các tinh thể thường có hình dạng không gian xác định.
2. Mạng tinh thể ion
Xét mạng tinh thể NaCl:
Mạng tinh thể NaCl có cấu trúc hình lập phương. Các ion Na+ và Cl− nằm ở các nút của mạng tinh thể một cách luân phiên. Trong tinh thể NaCl, cứ một ion Na+ được bao quanh bởi 6 ion Cl−. Ngược lại, một ion Cl− được bao quanh bởi 6 ion Na+ (hình 3.1).

Tinh thể NaCl được tạo bởi rất nhiều ion Na+ và Cl−, không có phân tử NaCl riêng biệt. Tuy vậy khi viết công thức phân tử muối natri clorua, để đơn giản người ta chỉ viết NaCl. Tương tự đối với các hợp chất ion khác như: KCl, MgCl[SUB]2[/SUB],... cũng viết như vậy.
3. Tính chất chung của hợp chất ion
Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể, có tính biền vững, thường có nhiệt độ nóng chảy và nhiệt độ sôi khá cao. Các hợp chất ion chỉ tồn tại ở dạng phân tử riêng rẽ khi chúng ở trạng thái hơi.
Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy và khi hòa tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện.
