Bùi Khánh Thu
Member
- Xu
- 25,443
Dưới đây là lý thuyết cũng như bài tập liên quan đến bài kim loại kiềm và hợp chất quan trọng của kim loại kiềm. Mời các bạn tham khảo
Bài tập kim loại kiềm và hợp chất quan trọng của kim loại kiềm
A. Kim loại kiềm
I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
- Kim loại kiềm thuộc nhóm IA của bảng tuần hoàn, gồm các nguyên tố: liti (Li), natri (Na), kali (K), rubiđi (Rb), xesi (Cs) và franxi (Fr)*.- Cấu hình electron nguyên tử:
Li: [He] 2s1 ; Na: [Ne] 3s1 ; K: [Ar]4s1 ; Rb: [Kr] 5s1 ; Cs: [Xe] 6s1
II. Tính chất vật lí
Các kim loại kiềm có màu trắng bạc và có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy và nhiệt độ sôi thấp, khối lượng riêng nhỏ, độ cứng thấp (do kim loại kiềm có mạng tinh thể lập phương tâm khối, cấu trúc tương đối rỗng, ngoài ra trong tinh thể các nguyên tử và ion liên kết với nhau bằng liên kết kim loại yếu).III. Tính chất hóa học
- Các nguyên tử kim loại kiềm có năng lượng ion hóa nhỏ nên có tính khử rất mạnh. Tính khử tăng dần từ liti đến xesi.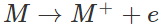
- Trong hợp chất, các kim loại kiềm có số oxi hóa +1.
1. Tác dụng với phi kim
Kim loại kiềm khử dễ dàng các nguyên tử phi kim thành ion âm:
- Tác dụng với oxi
Natri cháy trong khí oxi khô tạo ra natri peoxit (Na2O2), trong không khí khô ở nhiệt độ thường tạo ra natri oxit (Na2O).
- Tác dụng với clo
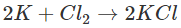
2. Tác dụng với axit
- Kim loại kiềm khử mạnh ion H+ trong dung dịch axit HCl và H2SO4 loãng thành khí hiđro:
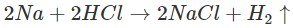
- Tất cả các kim loại kiềm đều nổ khi tiếp xúc với axit.
3. Tác dụng với nuớc
- Kim loại kiềm khử nước dễ dàng ở nhiệt độ thường, giải phóng khí hiđro.
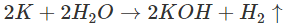
- Vì các kim loại kiềm dễ tác dụng với nước, với oxi trong không khí nên để bảo quản, người ta ngâm chìm các kim loại kiềm trong dầu hỏa.
IV. Ứng dụng, trạng thái tự nhiên và điều chế
1. Ứng dụng- Dùng chế tạo hợp kim có nhiệt độ nóng chảy thấp.
- Hợp kim liti - nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không.
- Xesi được dùng làm tế bào quang điện.
2. Trạng thái tự nhiên
- Các kim loại kiềm không có ở dạng đơn chất mà chỉ tồn tại ở dạng hợp chất. Trong nước biển có chứa một lượng tương đối lớn muối NaCl. Đất cũng chứa một số hợp chất của kim loại kiềm ở dạng silicat và aluminat.
3. Điều chế
- Muốn điều chế kim loại kiềm từ các hợp chất, cần phải khử các ion của chúng.
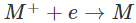
- Vì ion kim loại kiềm rất khó bị khử nên phải dùng dòng điện (phương pháp điện phân). Quan trọng nhất là điện phân muối halogenua của kim loại kiềm nóng chảy.
B. Một số hợp chất quan trọng của kim loại kiềm
I. Natri hiđroxit
1. Tính chất- Natri hiđroxit (NaOH) hay xút ăn da là chất rắn, không màu, dễ nóng chảy (tnc = 322oC), hút ẩm mạnh (dễ chảy rữa), tan nhiều trong nước và tỏa ra một lượng nhiệt lớn nên cần phải cẩn thận khi hòa tan NaOH trong nước.
- Khi tan trong nước, NaOH phân li hoàn toàn thành ion
- Natri hiđroxit tác dụng được với oxit axit, axit và muối:
2. Ứng dụng
- Natri hiđroxit là hóa chất quan trọng, đứng hàng thứ hai sau axit sunfuric.
- Natri hiđroxit được dùng để nấu xà phòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhôm trong công nghiệp luyện nhôm và dùng trong công nghiệp chế biến dầu mỏ,...
II. Natri hiđrocacbonat
1. Tính chất- Natri hiđrocacbonat (NaHCO3) là chất rắn màu trắng, ít tan trong nước, dễ bị nhiệt phân hủy tạo ra Na2CO3 và khí CO2.
- NaHCO3 có tính lưỡng tính (vừa tác dụng được với dung dịch axit, vừa tác dụng được với dung dịch bazơ).
2. Ứng dụng
- NaHCO3 được dùng trong công nghiệp dược phẩm (chế thuốc đau dạ dày,...) và công nghiệp thực phẩm (làm bột nở,...).
III. Natri cacbonat
1. Tính chất- Natri cacbonat (Na2CO3) là chất rắn màu trắng, tan nhiều trong nước. Ở nhiệt độ thường, natri cacbonat tồn tại ở dạng muối ngậm nước Na2CO3.10H2O, ở nhiệt độ cao muối này mất dần nước kết tinh trở thành natri cacbonat khan, nóng chảy ở 850oC.
- Na2CO3 là muối của axit yếu (axit cacbonic) và có những tính chất chung của muối.
- Muối cacbonat của kim loại kiềm trong dung dịch nước cho môi trường kiềm.
2. Ứng dụng
- Na2CO3 là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi,...
IV. Kali nitrat
1. Tính chất- Kali nitrat (KNO3) là những tinh thể không màu, bền trong không khí, tan nhiều trong nước. Khi đun nóng ở nhiệt độ cao hơn nhiệt độ nóng chảy (333oC), KNO3 bắt đầu bị phân hủy thành O2 và KNO2.
2. Ứng dụng
- KNO3 được dùng làm phân bón (phân đạm, phân kali) và được dùng để chế tạo thuốc nổ.
C. Bài tập
Câu 1: Nồng độ phần trăm của dung dịch tạo thành khi hòa tan 39 gam kali loại vào 362 gam nước là?
Ta có nK = 39 / 39 = 1 (mol)
PTHH: 2K + 2H2O → 2KOH + H2
=>nKOH = nK = 1 (mol) ; nH2 = nK / 2 = 0,05 (mol)
BTKL ta được: mdung dịch = 39 + 362 – 0,5.2 = 400 (gam)
=>Nồng độ phần trăm của dung dịch sau phản ứng C%KOH = (1,56/400) . 100% = 14%.
Câu 2: Điện phân muối clorua của một kim loại kiềm nóng chảy, thu được 0,896 lít khí (đktc) ở anot và 3,12 gam kim loại ở catot. Hãy xác định công thức phân tử của muối kim loại kiềm đó.
Ta có: nkhí = 0,896 / 22,4 =0,04 (mol)
PTHH: 2MCl →(đk: đpnc) 2M + Cl2
Từ phương trình phản ứng => nM = 2 nCl2 = 0,08 (mol)
=>M = 3,12 / 0,08 = 39 (g/mol). Kim loại M là K.
CTPT của muối kim loại kiềm là: KCl.
Câu 3: Cho 100 gam CaCO3 tác dụng hoàn toàn với dung dịch HCl thu được một lượng khí CO2. Sục lượng khí CO2 thu được vào dung dịch chứa 60 gam NaOH. Tính khối lượng muối tạo thành.
Ta có: nCaCO3 = 100 / 100 = 1 (mol) ; nNaOH = 60 / 40 = 1,5 (mol)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
Theo phương trình hóa học =>nCO2 = nCaCO3 = 1 (mol)
Vì 1 < nNaOH : nCO2 = 1,5 < 2 =>Tạo thành 2 muối
Gọi số mol của NaHCO3 và Na2CO3 lần lượt là x, y (mol)
CO2 + NaOH → NaHCO3
x x x (mol)
CO2 + 2NaOH → Na2CO3 + H2O
y 2y y (mol)
Ta có hệ phương trình: x + 2y = 1,5 và x + y =1 => x = y = 0,5.
=>mNaHCO3 = 84.0,5 = 42 (gam); mNa2CO3 = 106.0,5 = 53 (gam)
Khối lượng muối thu được: 42 + 53 = 95 (gam).
Câu 4: Nung 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng của hỗn hợp không đổi, được 69 gam chất rắn. Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp ban đầu.
Gọi số mol của NaHCO3 là x (mol)
PTHH: 2NaHCO3 →(to) Na2CO3 + CO2 ↑ + H2O ↑
x x/2
=>Khối lượng muối bị giảm: 84x – 53x = 31x = 100 – 69 = 31 (g)
=>x = 1 mol
=> %NaHCO3 = (84/100) . 100% = 84%
%Na2CO3 = 100% - 84% = 16%.
Câu 5: Cho 3,1 gam hỗn hợp gồm hai kim loại kiềm ở hai chu kì liên tiếp nhau trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 ở đktc và dung dịch kiềm.
a) Xác định tên hai kim loại đó và tính thành phần phần trăm khối lượng mỗi kim loại.
b) Tính thể tích dung dịch HCl 2M cần dùng để trung hòa dung dịch kiềm và khối lượng hỗn hợp muối clorua thu được.
a) Gọi công thức chung của 2 kim loại kiềm là M
Ta có nH2 = 1,12 / 22,4 = 0,05 (mol)
PTHH: 2M + 2H2O → 2MOH + H2
Từ PTHH => nM = 0,1 mol
=>Khối lượng mol trung bình là = 3,1 / 0,1 = 31 (g/mol)
Vậy 2 kim loại đó là Na và K
b) Gọi x, y lần lượt là số mol kim loại Na, K ta có:
23x + 39y = 3,1 và x + y = 0,1
=> x = y = 0,05 (mol)
Phần trăm khối lượng mỗi kim loại
% Na = (23.0,05 / 3,1) . 100% = 37,1%;
% K = 100% - 37,1% = 62,9%.
b) H+ + OH- → H2O
nHCl = nH+ = nMOH = 0,1 mol =>Vdung dịch HCl = 0,1 / 2 = 0,05 (lít)
mhh muối = mKL + mCl- = (31 + 35,5).0,1 = 6,65 (gam)
