Rượu trong hóa học là một hợp chất hữu cơ chứa nhóm -OH gắn vào một nguyên tử cácbon mà nó đến lượt mình lại gắn với một nguyên tử hiđrô hay các bon khác. Trong đời sống thông thường, từ rượu được hiểu như là những đồ uống có chứa cồn, (cồn (êtanol) hay rượu êtylíc) (C2H5OH).
1. Cấu trúc
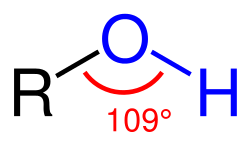
Nhóm chức năng của rượu là nhóm hyđrôxil -OH gắn với cácbon lai sp³. Còn gọi là nhóm chức rượu.
Công thức tổng quát: R(OH)n với n \lb 1.R là gốc hiđrocacbon
Đặc biệt rượu no, mạch thẳng, một lần rượu có CTPT : CnH2n+1OH.
- Nhóm hiđroxyl OH với mối liên kết O - H phân cực đáng kể.
- Gốc R có thể là mạch hở no hay chưa no hoặc mạch vòng
Rượu không bền khi:
+ Nhiều nhóm OH cùng đính vào 1 nguyên tử C.
+ Nhóm OH đính vào nguyên tử C có nối đôi.
Ví dụ:
R – CH(OH) – OH -> R – CHO + H[SUB]2[/SUB]O
R – C (OH)[SUB]3[/SUB] -> R – COOH + H[SUB]2[/SUB]O
R – CH = CH – OH -> R – CH[SUB]2[/SUB] – CHO
Hiện tượng đồng phân là do:
+ Mạch C khác nhau.
+ Vị trí của các nhóm OH khác nhau.
+ Ngoài ra rượu đơn chức còn đồng phân là ete oxit R - O - R'.
Ví dụ: Chất đơn giản C[SUB]3[/SUB]H[SUB]8[/SUB]O có 3 đồng phân.
CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – CH[SUB]2[/SUB] – OH (propanol – 1)
CH[SUB]3[/SUB] – CH (CH[SUB]3[/SUB]) – OH (propanol -2)
CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – O – CH[SUB]3[/SUB] (Etyl metylete)
cách gọi tên
a) Tên thông dụng:
Tên rượu = Tên gốc hiđrocacbon no tương ứng + ic.
Ví dụ: CH[SUB]3[/SUB] - CH[SUB]2[/SUB] - OH rượu etylic
b) Tên hợp pháp
Tên rượu = tên hiđrocacbon no tương ứng + ol.
CH[SUB]3[/SUB] – CH(OH) – CH[SUB]2[/SUB] – CH(CH[SUB]3[/SUB]) – CH[SUB]2[/SUB] – CH[SUB]3[/SUB] (4- metylhexaol)
2. Tính chất vật lý
Nhóm hiđrôxyl làm cho phân tử rượu phân cực. Nhóm này có thể tạo ra những liên kết hiđrô với nhau hoặc với chất khác. Hai xu hướng hòa tan đối chọi nhau trong các rượu là: xu hướng của nhóm -OH phân cực tăng tính hòa tan trong nước và xu hướng của chuỗi cácbon ngăn cản điều này. Vì vậy, mêtanol, êtanol và prôpanol dễ hòa tan trong nước vì nhóm hiđrôxyl chiếm ưu thế. Butanol hòa tan vừa phải trong nước do sự cân bằng của hai xu hướng. Pentanol và các butanol mạch nhánh hầu như không hòa tan trong nước do sự thắng thế của chuỗi cácbon. Vì lực liên kết hóa học cao trong liên kết của rượu nên chúng có nhiệt độ bốc cháy cao. Vì liên kết hiđrô, rượu có nhiệt độ sôi cao hơn so với hiđrôcácbon và ête tương ứng. Mọi rượu đơn giản đều hòa tan trong các dung môi hữu cơ.
Rượu còn được coi là những dung môi. Chúng có thể mất prôton H+ trong nhóm hiđrôxyl và vì vậy chúng có tính axít rất yếu: yếu hơn nước (ngoại trừ mêtanol), nhưng mạnh hơn amôniắc (NH[SUB]4[/SUB]OH hay NH[SUB]3[/SUB]) hay axêtylen (C[SUB]2[/SUB]H[SUB]2[/SUB]).
- Đối với rượu no, mạch hở, một lần rượu CnH2n+1OH :
Khi n = 1 \sr 12 ; rượu là chất lỏng, n > 12 là chất rắn, nhiệt độ sôi của rượu cao hơn của hiđrocacbon no hay dẫn xuất halogen có KLPT xấp xỉ vì trong rượu có hiện tượng liên hợp phân tử nhờ liên kết H, do đó sự bay hơi khó khăn.
- Tất cả các rượu đơn chức đều nhẹ hơn nước.
- Ba chất đầu (metanol, etanol, propanol) tan vô hạn trong nước là do khi hoà tan rượu vào nước, giữa các phân tử rượu và các phân tử nước hình thành liên kết hiđro:
Sau đó độ tan giảm nhanh khi n
- Độc tính: Etanol
Các hình thức đồ uống chứa cồn được sử dụng từ rất lâu trong lịch sử loài người vì nhiều nguyên nhân như hội hè, ăn kiêng, y tế, tôn giáo v.v. Việc sử dụng một lượng vừa phải êtanol thì không có hại hoặc có thể có lợi cho cơ thể nhưng một lượng lớn rượu có thể dẫn đến tình trạng say rượu hay ngộ độc rượu cấp tính và các tình trạng nguy hiểm cho sức khỏe như: nôn ọe, khó thở do thiếu ôxi, lạnh, đột tử hoặc tình trạng nghiện rượu đẫn đến tổn thương gan, não nếu sử dụng thường xuyên.
Các loại rượu khác độc hơn êtanol rất nhiều, một phần vì chúng tốn nhiều thời gian hơn để phân hủy cũng như trong quá trình phân hủy chúng tạo ra nhiều chất độc cho cơ thể. Mêtanol (rượu gỗ) được ôxi hóa bởi các enzim khử hiđrô trong gan tạo ra phoócmanđêhit (phoóc môn) có thể gây mù hoặc tử vong.
Uống nhiều rượu rất có hại với sức khoẻ, người nghiện rượu có thể mắc bệnh suy sinh dưỡng, giảm thị lực...
Metanol
Metanol rất độc, chỉ một lượng nhỏ xâm nhập vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong. Một điều thú vị là để ngăn chặn ngộ độc do dùng nhầm mêtanol thì người ta cho người bị ngộ độc dùng êtanol. Êtanol sẽ liên kết với các enzim khử hiđrô và ngăn không cho mêtanol liên kết với các enzim này
3. Tính chất hóa học
Tác dụng với kim loại kiềm.
2R – OH +2 Na -> 2R – ONa + H[SUB]2[/SUB]
Các ancolat là chất rắn, tan nhiều trong rượu tương ứng, bị thuỷ phân hoàn toàn.
Phản ứng este hoá với axit hữu cơ và vô cơ
R – OH + HCl \sr R – Cl + H2O
R – OH + HO – OCO – CH[SUB]3[/SUB] \sr R – O – CO – CH[SUB]3[/SUB] + H[SUB]2[/SUB]O
- Các phản ứng este hoá đều thuận nghịch, không hoàn toàn. Muốn phản ứng xảy ra hoàn toàn theo chiều thuận phải dùng H2SO4 đặc để hút nước.
- Phân biệt:
Rượu bậc 1: phản ứng chậm, không hoàn toàn.
Rượu bậc 2: phản ứng rất chậm.
Rượu bậc 3: gần như không xảy ra phản ứng.
. Phản ứng tách nước
-Tạo ete:
2CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – OH \sr CH[SUB]3[/SUB] – CH[SUB]3[/SUB] – O – CH[SUB]2[/SUB] – CH[SUB]3 [/SUB]+ H[SUB]2[/SUB]O ( xúc tác H[SUB]2[/SUB]SO[SUB]4[/SUB] đặc. 140 độ)
- Tạo olefin:
CH[SUB]3[/SUB] – CH[SUB]2 [/SUB]– OH \sr CH[SUB]2[/SUB] = CH[SUB]2[/SUB] + H[SUB]2[/SUB]O ( xúc tác H[SUB]2[/SUB]SO[SUB]4 [/SUB]đặc , 180 độ)
Phản ứng tách hiđro: Cho hơi rượu qua bột Cu hay bột Fe nung nóng.
Rượu bậc 1 \sranđehit.
Rượu bậc 2 \sr xeton.
CH[SUB]3[/SUB] – CH[SUB]2 [/SUB]– OH – CH[SUB]3 [/SUB]= CHO + H[SUB]2[/SUB]
CH[SUB]3[/SUB] – CH(OH) – C[SUB]2[/SUB]H[SUB]5[/SUB] – CH[SUB]3 [/SUB]– CO – C[SUB]2[/SUB]H[SUB]5[/SUB] + H[SUB]2[/SUB]
. Phản ứng oxi hoá không hoàn toàn (êm dịu)
R – CH[SUB]2[/SUB] – OH + 0,5 O[SUB]2[/SUB] – R – CHO + H[SUB]2[/SUB]O (xúc tác Cu)
Riêng rượu etylic bị lên men giấm.
CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – OH + O[SUB]2[/SUB] – CH[SUB]3 [/SUB]– COOH + H[SUB]2[/SUB]O
4. Điều chế
Phần lớn các loại rượu được sản xuất bằng phương pháp hóa học từ các chất hữu cơ sẵn có trong tự nhiên như dầu mỏ, hơi đốt hoặc than. Trong công nghiệp sản xuất đồ uống người ta sử dụng phương pháp khác: lên men hoa quả hoặc ngũ cốc để tạo ra đồ uống có chứa cồn (êtanol). Ngoài ra, trong phòng thí nghiệm, nếu chỉ cần một lượng nhỏ, ta có nhiều cách để tạo như:
Các phương pháp chung cho rượu no đơn chức
* Hidrat hóa anken (cộng nước vào anken): Đun nóng anken với nước và chất xúc tác axit H[SUB]2[/SUB]SO[SUB]4[/SUB], HCl, HBr, HClO[SUB]4[/SUB]... Phản ứng theo cơ chế electrophin theo quy tắc Markovnikov (quy tắc Macconhicop).
CH[SUB]2[/SUB]=CH[SUB]2[/SUB] + H[SUB]2[/SUB]O → CH[SUB]3[/SUB]-CH[SUB]2[/SUB]OH (Xúc tác H+)
* Thủy phân dẫn xuất halogen: Đun nóng halogen trong dung dịch kiềm.
C[SUB]2[/SUB]H[SUB]5[/SUB]Br + NaOH → C[SUB]2[/SUB]H[SUB]5[/SUB]OH + NaBr
* Đi từ andehit và xeton: Cộng hydro khi có xúc tác kim loại như Ni,Pt... cũng tạo thành ancol bậc I.
CH[SUB]3[/SUB]CHO + H[SUB]2 [/SUB]→ CH[SUB]3[/SUB]-CH[SUB]2[/SUB]OH (Có xúc tác)
Một số phương pháp riêng
* Lên men tạo etanol từ tinh bột hoặc xenlulozo
(C[SUB]6[/SUB]H[SUB]10[/SUB]O[SUB]5[/SUB])n + nH[SUB]2[/SUB]O → nC[SUB]6[/SUB]H[SUB]12[/SUB]O[SUB]6[/SUB]
C[SUB]6[/SUB]H[SUB]12[/SUB]O[SUB]6[/SUB] → 2C[SUB]2[/SUB]H[SUB]5[/SUB]OH + 2CO[SUB]2[/SUB]
* Tạo metanol: CO + 2H[SUB]2[/SUB] → CH[SUB]3[/SUB]OH (300-400°C và 250-300 at)
hoặc dùng: 2 CH[SUB]4[/SUB] + O[SUB]2 [/SUB]→ 2 CH[SUB]3[/SUB]OH (200°C, 100 at)
* Thủy phân dầu mỡ động vật tạo glixerin

1. Cấu trúc
Nhóm chức năng của rượu là nhóm hyđrôxil -OH gắn với cácbon lai sp³. Còn gọi là nhóm chức rượu.
Công thức tổng quát: R(OH)n với n \lb 1.R là gốc hiđrocacbon
Đặc biệt rượu no, mạch thẳng, một lần rượu có CTPT : CnH2n+1OH.
- Nhóm hiđroxyl OH với mối liên kết O - H phân cực đáng kể.
- Gốc R có thể là mạch hở no hay chưa no hoặc mạch vòng
Rượu không bền khi:
+ Nhiều nhóm OH cùng đính vào 1 nguyên tử C.
+ Nhóm OH đính vào nguyên tử C có nối đôi.
Ví dụ:
R – CH(OH) – OH -> R – CHO + H[SUB]2[/SUB]O
R – C (OH)[SUB]3[/SUB] -> R – COOH + H[SUB]2[/SUB]O
R – CH = CH – OH -> R – CH[SUB]2[/SUB] – CHO
Hiện tượng đồng phân là do:
+ Mạch C khác nhau.
+ Vị trí của các nhóm OH khác nhau.
+ Ngoài ra rượu đơn chức còn đồng phân là ete oxit R - O - R'.
Ví dụ: Chất đơn giản C[SUB]3[/SUB]H[SUB]8[/SUB]O có 3 đồng phân.
CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – CH[SUB]2[/SUB] – OH (propanol – 1)
CH[SUB]3[/SUB] – CH (CH[SUB]3[/SUB]) – OH (propanol -2)
CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – O – CH[SUB]3[/SUB] (Etyl metylete)
cách gọi tên
a) Tên thông dụng:
Tên rượu = Tên gốc hiđrocacbon no tương ứng + ic.
Ví dụ: CH[SUB]3[/SUB] - CH[SUB]2[/SUB] - OH rượu etylic
b) Tên hợp pháp
Tên rượu = tên hiđrocacbon no tương ứng + ol.
CH[SUB]3[/SUB] – CH(OH) – CH[SUB]2[/SUB] – CH(CH[SUB]3[/SUB]) – CH[SUB]2[/SUB] – CH[SUB]3[/SUB] (4- metylhexaol)
2. Tính chất vật lý
Nhóm hiđrôxyl làm cho phân tử rượu phân cực. Nhóm này có thể tạo ra những liên kết hiđrô với nhau hoặc với chất khác. Hai xu hướng hòa tan đối chọi nhau trong các rượu là: xu hướng của nhóm -OH phân cực tăng tính hòa tan trong nước và xu hướng của chuỗi cácbon ngăn cản điều này. Vì vậy, mêtanol, êtanol và prôpanol dễ hòa tan trong nước vì nhóm hiđrôxyl chiếm ưu thế. Butanol hòa tan vừa phải trong nước do sự cân bằng của hai xu hướng. Pentanol và các butanol mạch nhánh hầu như không hòa tan trong nước do sự thắng thế của chuỗi cácbon. Vì lực liên kết hóa học cao trong liên kết của rượu nên chúng có nhiệt độ bốc cháy cao. Vì liên kết hiđrô, rượu có nhiệt độ sôi cao hơn so với hiđrôcácbon và ête tương ứng. Mọi rượu đơn giản đều hòa tan trong các dung môi hữu cơ.
Rượu còn được coi là những dung môi. Chúng có thể mất prôton H+ trong nhóm hiđrôxyl và vì vậy chúng có tính axít rất yếu: yếu hơn nước (ngoại trừ mêtanol), nhưng mạnh hơn amôniắc (NH[SUB]4[/SUB]OH hay NH[SUB]3[/SUB]) hay axêtylen (C[SUB]2[/SUB]H[SUB]2[/SUB]).
- Đối với rượu no, mạch hở, một lần rượu CnH2n+1OH :
Khi n = 1 \sr 12 ; rượu là chất lỏng, n > 12 là chất rắn, nhiệt độ sôi của rượu cao hơn của hiđrocacbon no hay dẫn xuất halogen có KLPT xấp xỉ vì trong rượu có hiện tượng liên hợp phân tử nhờ liên kết H, do đó sự bay hơi khó khăn.
- Tất cả các rượu đơn chức đều nhẹ hơn nước.
- Ba chất đầu (metanol, etanol, propanol) tan vô hạn trong nước là do khi hoà tan rượu vào nước, giữa các phân tử rượu và các phân tử nước hình thành liên kết hiđro:
Sau đó độ tan giảm nhanh khi n
- Độc tính: Etanol
Các hình thức đồ uống chứa cồn được sử dụng từ rất lâu trong lịch sử loài người vì nhiều nguyên nhân như hội hè, ăn kiêng, y tế, tôn giáo v.v. Việc sử dụng một lượng vừa phải êtanol thì không có hại hoặc có thể có lợi cho cơ thể nhưng một lượng lớn rượu có thể dẫn đến tình trạng say rượu hay ngộ độc rượu cấp tính và các tình trạng nguy hiểm cho sức khỏe như: nôn ọe, khó thở do thiếu ôxi, lạnh, đột tử hoặc tình trạng nghiện rượu đẫn đến tổn thương gan, não nếu sử dụng thường xuyên.
Các loại rượu khác độc hơn êtanol rất nhiều, một phần vì chúng tốn nhiều thời gian hơn để phân hủy cũng như trong quá trình phân hủy chúng tạo ra nhiều chất độc cho cơ thể. Mêtanol (rượu gỗ) được ôxi hóa bởi các enzim khử hiđrô trong gan tạo ra phoócmanđêhit (phoóc môn) có thể gây mù hoặc tử vong.
Uống nhiều rượu rất có hại với sức khoẻ, người nghiện rượu có thể mắc bệnh suy sinh dưỡng, giảm thị lực...
Metanol
Metanol rất độc, chỉ một lượng nhỏ xâm nhập vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong. Một điều thú vị là để ngăn chặn ngộ độc do dùng nhầm mêtanol thì người ta cho người bị ngộ độc dùng êtanol. Êtanol sẽ liên kết với các enzim khử hiđrô và ngăn không cho mêtanol liên kết với các enzim này
3. Tính chất hóa học
Tác dụng với kim loại kiềm.
2R – OH +2 Na -> 2R – ONa + H[SUB]2[/SUB]
Các ancolat là chất rắn, tan nhiều trong rượu tương ứng, bị thuỷ phân hoàn toàn.
Phản ứng este hoá với axit hữu cơ và vô cơ
R – OH + HCl \sr R – Cl + H2O
R – OH + HO – OCO – CH[SUB]3[/SUB] \sr R – O – CO – CH[SUB]3[/SUB] + H[SUB]2[/SUB]O
- Các phản ứng este hoá đều thuận nghịch, không hoàn toàn. Muốn phản ứng xảy ra hoàn toàn theo chiều thuận phải dùng H2SO4 đặc để hút nước.
- Phân biệt:
Rượu bậc 1: phản ứng chậm, không hoàn toàn.
Rượu bậc 2: phản ứng rất chậm.
Rượu bậc 3: gần như không xảy ra phản ứng.
. Phản ứng tách nước
-Tạo ete:
2CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – OH \sr CH[SUB]3[/SUB] – CH[SUB]3[/SUB] – O – CH[SUB]2[/SUB] – CH[SUB]3 [/SUB]+ H[SUB]2[/SUB]O ( xúc tác H[SUB]2[/SUB]SO[SUB]4[/SUB] đặc. 140 độ)
- Tạo olefin:
CH[SUB]3[/SUB] – CH[SUB]2 [/SUB]– OH \sr CH[SUB]2[/SUB] = CH[SUB]2[/SUB] + H[SUB]2[/SUB]O ( xúc tác H[SUB]2[/SUB]SO[SUB]4 [/SUB]đặc , 180 độ)
Phản ứng tách hiđro: Cho hơi rượu qua bột Cu hay bột Fe nung nóng.
Rượu bậc 1 \sranđehit.
Rượu bậc 2 \sr xeton.
CH[SUB]3[/SUB] – CH[SUB]2 [/SUB]– OH – CH[SUB]3 [/SUB]= CHO + H[SUB]2[/SUB]
CH[SUB]3[/SUB] – CH(OH) – C[SUB]2[/SUB]H[SUB]5[/SUB] – CH[SUB]3 [/SUB]– CO – C[SUB]2[/SUB]H[SUB]5[/SUB] + H[SUB]2[/SUB]
. Phản ứng oxi hoá không hoàn toàn (êm dịu)
R – CH[SUB]2[/SUB] – OH + 0,5 O[SUB]2[/SUB] – R – CHO + H[SUB]2[/SUB]O (xúc tác Cu)
Riêng rượu etylic bị lên men giấm.
CH[SUB]3[/SUB] – CH[SUB]2[/SUB] – OH + O[SUB]2[/SUB] – CH[SUB]3 [/SUB]– COOH + H[SUB]2[/SUB]O
4. Điều chế
Phần lớn các loại rượu được sản xuất bằng phương pháp hóa học từ các chất hữu cơ sẵn có trong tự nhiên như dầu mỏ, hơi đốt hoặc than. Trong công nghiệp sản xuất đồ uống người ta sử dụng phương pháp khác: lên men hoa quả hoặc ngũ cốc để tạo ra đồ uống có chứa cồn (êtanol). Ngoài ra, trong phòng thí nghiệm, nếu chỉ cần một lượng nhỏ, ta có nhiều cách để tạo như:
Các phương pháp chung cho rượu no đơn chức
* Hidrat hóa anken (cộng nước vào anken): Đun nóng anken với nước và chất xúc tác axit H[SUB]2[/SUB]SO[SUB]4[/SUB], HCl, HBr, HClO[SUB]4[/SUB]... Phản ứng theo cơ chế electrophin theo quy tắc Markovnikov (quy tắc Macconhicop).
CH[SUB]2[/SUB]=CH[SUB]2[/SUB] + H[SUB]2[/SUB]O → CH[SUB]3[/SUB]-CH[SUB]2[/SUB]OH (Xúc tác H+)
* Thủy phân dẫn xuất halogen: Đun nóng halogen trong dung dịch kiềm.
C[SUB]2[/SUB]H[SUB]5[/SUB]Br + NaOH → C[SUB]2[/SUB]H[SUB]5[/SUB]OH + NaBr
* Đi từ andehit và xeton: Cộng hydro khi có xúc tác kim loại như Ni,Pt... cũng tạo thành ancol bậc I.
CH[SUB]3[/SUB]CHO + H[SUB]2 [/SUB]→ CH[SUB]3[/SUB]-CH[SUB]2[/SUB]OH (Có xúc tác)
Một số phương pháp riêng
* Lên men tạo etanol từ tinh bột hoặc xenlulozo
(C[SUB]6[/SUB]H[SUB]10[/SUB]O[SUB]5[/SUB])n + nH[SUB]2[/SUB]O → nC[SUB]6[/SUB]H[SUB]12[/SUB]O[SUB]6[/SUB]
C[SUB]6[/SUB]H[SUB]12[/SUB]O[SUB]6[/SUB] → 2C[SUB]2[/SUB]H[SUB]5[/SUB]OH + 2CO[SUB]2[/SUB]
* Tạo metanol: CO + 2H[SUB]2[/SUB] → CH[SUB]3[/SUB]OH (300-400°C và 250-300 at)
hoặc dùng: 2 CH[SUB]4[/SUB] + O[SUB]2 [/SUB]→ 2 CH[SUB]3[/SUB]OH (200°C, 100 at)
* Thủy phân dầu mỡ động vật tạo glixerin
