ong noi loc
New member
- Xu
- 26
Fe và một số kim loại quan trong khác như Cr , Cu , Zn là những vật dụng kim loại mà hằng ngày chúng ta thường gặp , trong đó Fe là kim loại mà ai cũng bắt gặp , vậy Fe có tính chất như thế nào mà lại được sử dụng rộng rãi trong đời sống mời các bạn tham khảo bài học dưới đây.

CHƯƠNG VII SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG.
BÀI 31 : SẮT

CHƯƠNG VII SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG.
BÀI 31 : SẮT
I- VỊ TRÍ VÀ CẤU TẠO
1. Vị trí của sắt trong bảng tuần hoàn
Sắt là nguyên tố kim loại chuyển tiếp, thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 26.

2. Cấu tạo của sắt
- Cấu hình electron
Nguyên tử Fe có 26 electron, được phân bố thành 4 lớp: 2e,8e,14e,2e.
Sắt là nguyên tố d, có cấu hình electron nguyên tử: 1s22s22p63s23p63d64s2 hay viết gọn là:

Khi tạo ra các ion sắt, nguyên tử Fe nhường electron ở phân lớp 4s trước phân lớp 3d. Thí dụ:
Nguyên tử Fe nhường 2e ở phân lớp 4s tạo ra ion Fe[SUP]2+[/SUP], có cấu hình electron:

Nguyên tử Fe nhường 2e ở phân lớp 4s và 1e ở phân lớp 3d tạo ra ion Fe3+, có cấu hình electron:

Nhận xét: Tương tự nguyên tốCr , khi tham gia phản ứng hóa học, nguyên tử Fe không chỉ nhường electron ở phân lớp 4s mà có thể nhường thêm electron ở phân lớp 3d , tạo ra những ion có điện tích khác nhau là Fe[SUP]2+ [/SUP]và Fe[SUP]3+ [/SUP]. Trong hợp chất, Fe có số oxi hóa +2 hoặc +3.
- Một số đại lượng của nguyên tử
Bán kính nguyên tử Fe : 0,162 (nm)
Bán kính các ion Fe[SUP]2+[/SUP] và Fe[SUP]3+[/SUP]: 0,076 và 0,064 (nm)
Năng lượng ion hóa I1 ,I2 và I3 : 760 , 1560 , 2960 (kJ/mol)
Độ âm điện :1,83
Thế điện cực chuẩn EoFe[SUP]2+[/SUP]/Fe :−0,44(V) , EoFe[SUP]3+[/SUP]/Fe[SUP]2+[/SUP]: +0,77(V)
- Cấu tạo của đơn chất
Tùy thuộc vào nhiệt độ, kim loại Fe có thể tồn tại ở các mạng tinh thể lập phương tâm khối (Feα) hoặc lập phương tâm diện (Feγ).
II- TÍNH CHẤT VẬT LÍ.
Sắt là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540[SUP]o[/SUP]C, có khối lượng riêng 7,9g/cm3. Sắt có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.

III- TÍNH CHẤT HÓA HỌC
Những đặc điểm về cấu tạo và đại lượng đặc trưng của nguyên tử Fe nêu ở trên cho thấy tính chất hóa học cơ bản của sắt là tính khử trung bình: Fe có thể bị oxi hóa thành Fe[SUP]2+[/SUP] hoặc Fe[SUP]3+[/SUP].
1. Tác dụng với phi kim
Fe khử nhiều phi kim thành ion âm trong khi đó Fe bị oxi hóa thành Fe[SUP]2+[/SUP] thành Fe[SUP]3+[/SUP].
Thí dụ:
Fe + S →FeS
3Fe + 2O[SUB]2[/SUB] → Fe[SUB]3[/SUB]O[SUB]4[/SUB]
2Fe + 3Cl[SUB]2 [/SUB] → 2FeCl[SUB]3[/SUB]

Fe khử dễ dàng ion H[SUP]+[/SUP]trong dung dịch axit HCl hoặc H[SUB]2[/SUB]SO[SUB]4[/SUB] loãng thành hiđro đồng thời Fe bị oxi hóa thành Fe[SUP]2+[/SUP]:
Fe + H[SUB]2[/SUB]SO[SUB]4 [/SUB]→ FeSO[SUB]4 [/SUB]+ H[SUB]2[/SUB]↑
Fe + 4HNO[SUB]3([/SUB]loãng) → Fe(NO[SUB]3[/SUB])[SUB]3 [/SUB]+ 2H[SUB]2[/SUB]O + NO↑
Axit HNO[SUB]3[/SUB]và H[SUB]2[/SUB]SO[SUB]4[/SUB] đặc nguội không tác dụng với sắt mà còn làm cho sắt trở nên thụ động.
3. Tác dụng với dung dịch muối
Sắt khử được những ion kim loại đứng sau nó trong dãy điện hóa (có thế điện cực chuẩn lớn hơn −0,44V ).
Thí dụ:
Fe + CuSO4 → FeSO[SUB]4[/SUB] + Cu↓
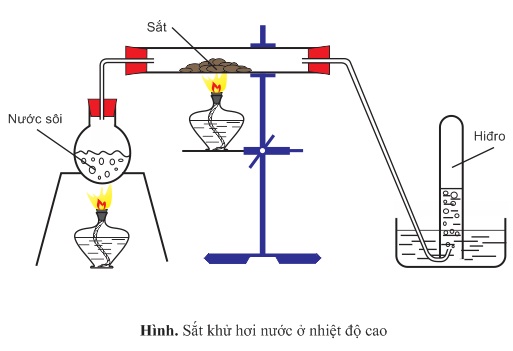
4. Tác dụng với nước
Ở nhiệt độ cao, sắt khử được hơi nước
3Fe + 4H[SUB]2[/SUB]O → Fe[SUB]3[/SUB]O[SUB]4[/SUB] + 4H[SUB]2[/SUB]↑ ( < 570[SUP]o[/SUP]C)
IV- TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên, sắt ở trạng thái tự do trong các mảnh thiên thạch. Những hợp chất của sắt tồn tại dưới dạng quặng sắt thì rất phong phú (sắt chiếm tới
5% khối lượng vỏ Trái Đất, đứng hàng thứ tư trong các nguyên tố, hàng thứ hai trong các kim loại, sau nhôm). Một số quặng sắt quan trọng là:
Quặng hematit đỏ chứa Fe[SUB]2[/SUB]O[SUB]3[/SUB] khan. Quặng hematit nâu chứa Fe[SUB]2[/SUB]O[SUB]3[/SUB].nH2O .Quặng manhetit chứa Fe[SUB]3[/SUB]O[SUB]4[/SUB] là quặng giàu sắt nhất, nhưng hiếm có trong tự nhiên. Ngoài ra còn có quặng xiđerit chứa FeCO[SUB]3[/SUB] , quặng pirit sắt chứa FeS[SUB]2[/SUB].
Để sản xuất gang người ta thường dùng manđetit và hemantit.
Hợp chất sắt còn có mặt trong hồng cầu của máu, làm nhiệm vụ chuyển tải oxi đến các tế bào cơ thể để duy trì sự sống của con người và động vật.
Bài tập :
1/ Cho biết nhất các chất đều td được với Fe ?
a.NaOH , HCl , HNO3l , CuO
b. NaHSO4 , AlCl3 , HCl , ZnO
c. H2SO4 đăc nguội , CuCl2 , S , Cl2.
d. H2SO4 l , H2SO4 đặc nóng , HNO3 đặc nóng.
2/ Trong điều kiện nào thì Fe bị oxihoa thành Fe+3.
a. Với Cl2 đốt nóng
b. Với S đốt nóng
c. với HCl đun nóng
d. với HNO3 loãng lạnh.
3/ Fe khử được nhưng ion nào ra khỏi hợp chất của chúng.
a. Cu2+ , Ag+ , Ni2+ , Al3+
b. Cu+ , Ag+ , Ni2+ , Sn2+
c. Al3+, Cu2+ , Ag+ , Hg2+
d. Mn2+ , Cu+ , Ag +, Pb2+
4/ 2,52 g một kim loại td vừa đủ với H2SO4 thu được 6,84g muối , kim loại đó là ?
a. Cu
b. Ni
c. Fe
d. Pb
5/ Cho hỗn hợp 12,1 g hỗn hợp Fe và Zn td với HCl dư thu được 4,48l khí H2. Khối lượng Fe trong hỗn hợp là ?
a. 6,8g
b. 5,6g
c. 4,75g
d. 7,2g
Đáp án :
1/ d
2/ a
3/ b
4/ c
5/ b
2/ a
3/ b
4/ c
5/ b
Sửa lần cuối bởi điều hành viên:
