ong noi loc
New member
- Xu
- 26
BÀI Ý NGHĨA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC.

Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại (xem sơ đồ sau):
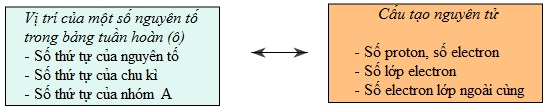
Nguyên tử của nguyên tố đó có 19 proton, 19 electron, có 4 lớp electron (vì số lớp electron bằng số thứ tự của chu kì), có 1 electron ở lớp ngoài cùng (vì số electron lớp ngoài cùng bằng số thứ tự nhóm A). Đó là nguyên tố kali.
Thí dụ 2: Biết cấu hình electron nguyên tử của một nguyên tố là 1s[SUP]2[/SUP]2s[SUP]2[/SUP]2p[SUP]6[/SUP]3s[SUP]2[/SUP]3p[SUP]4[/SUP] có thể suy ra:
Tổng số electron của nguyên tử nguyên tố đó là 16, vậy nguyên tố đó chiếm ô thứ 16 trong bảng tuần hoàn (vì nguyên tử 16 electron, 16 proton, số đơn vị điện tích hạt nhân là 16 bằng số thứ tự của nguyên tố trong bảng tuần hoàn) .
Nguyên tố đó thuộc chu kì 3 (vì có 3 lớp electron), nhóm VIA (vì có 6 electron lớp ngoài cùng). Đó là nguyên tố lưu huỳnh.
II - QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH CHẤT CỦA NGUYÊN TỐ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra những tính chất hóa học cơ bản của nó.
- Tính kim loại, tính phi kim: Các nguyên tố ở các nhóm IA, IIA,IIIA (trừ hiđro và bo) có tính kim loại. Các nguyên tố ở các nhóm VA, VIA, VIIA có tính phi kim (trừ antimon, bitmut và poloni).
- Hóa trị cao nhất của nguyên tố với oxi, hóa trị với hiđro.
- Công thức của oxit cao nhất và hiđroxit tương ứng.
- Công thức của hợp chất khí với hiđro (nếu có).
- Oxit và hiđroxit có tính axit hay bazơ.
Thí dụ: Nguyên tố lưu huỳnh ở ô thứ 16, nhóm VIA, chu kì 3. Suy ra lưu huỳnh là phi kim.
Hóa trị cao nhất với oxi là 6, công thức của oxit cao nhất là SO3.
Hóa trị với hiđro là 2, công thức của hợp chất khí với hiđro là H2S.
SO3 là oxit axit và H2SO4 là axit mạnh.
III - SO SÁNH TÍNH CHẤT HÓA HỌC CỦA MỘT NGUYÊN TỐ VỚI CÁC NGUYÊN TỐ LÂN CẬN
Dựa vào quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn có thể so sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
Thí dụ: So sánh tính chất hóa học của P (Z=15) với Si (Z=14) và S (Z=16), với N (Z=7) và As (Z=33).
Trong bảng tuần hoàn, các nguyên tố Si, P, S thuộc cùng một chu kì. Nếu xếp theo thứ tự điện tích hạt nhân tăng dần ta được Si, P, S. Trong chu kì, theo chiều điện tích hạt nhân tăng thì tính phi kim tăng. Vậy P có tính phi kim yếu hơn S và mạnh hơn Si.
Trong nhóm VA, theo chiều điện tích hạt nhân tăng dần, tính phi kim giảm dần. Vì vậy theo thứ tự N, P, As thì P có tính phi kim yếu hơn N và mạnh hơn As.
Vậy P có tính phi kim yếu hơn N và S, hiđroxit của nó là H[SUB]3[/SUB]PO[SUB]4[/SUB] có tính axit yếu hơn HNO[SUB]3[/SUB] và H[SUB]2[/SUB]SO[SUB]4[/SUB].
