ong noi loc
New member
- Xu
- 26
BÀI NĂNG LƯỢNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ VÀ CẤU
HÌNH ELECTRON
HÌNH ELECTRON
PHẦN II.
2. Nguyên lí vững bền
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt những obitan có mức năng lượng từ thấp đến cao.
Thí dụ :
Nguyên tử hiđro (Z=1) có 1 electron, electron này sẽ chiếm obitan 1s(AO−1s) có mức năng lượng thấp. Do đó có thể biểu diễn sự phân bố electron của nguyên tử hiđro là 1s1; Biểu diễn bằng ô lượng tử là :

Nguyên tử heli (Z=2) có 2 electron. Theo nguyên lí Pau-li, hai electron này cùng chiếm obitan 1s có mức năng lượng thấp nhất. Bởi vậy sự phân bố electron trên obitan của heli là 1s2→

Nguyên tử liti (Z=3) có 3 electron, 2 electron trước chiếm obitan 1s và đã bão hoà, electron còn lại chiếm obitan 2s tiếp theo có mức năng lượng cao hơn. Do đó sự phân bố electron trên các obitan của liti là :
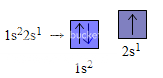
Một cách tương tự, ta có thể viết được sự phân bố electron trên các obitan của các nguyên tố tiếp theo. Thí dụ :
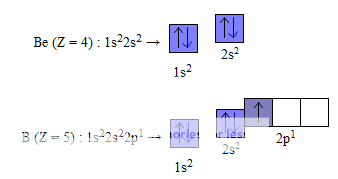
Tuy nhiên, không nhất thiết lúc nào cũng phải biểu diễn các AO−2p phải cao hơn AO−2s,... vì sẽ cồng kềnh. Người ta chỉ biểu diễn sự cao, thấp của các ô lượng tử khi cần thể hiện mức năng lượng khác nhau của từng phân lớp electron.
3. Quy tắc Hun
Trong cùng một phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
Thí dụ sự phân bố electron trên các obitan của nguyên tử cacbon, nitơ như sau :
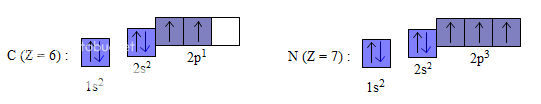
III- CẤU HÌNH ELECTRON NGUYÊN TỬ
1. Cấu hình electron nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Quy ước cách viết cấu hình electron nguyên tử :
- Số thứ tự lớp electron được viết bằng các chữ số (1,2,3...)
- Phân lớp được kí hiệu bằng chữ cái thường (s,p,d,f)
- Số electron được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp (s2,p2,...)
Cách viết cấu hình electron nguyên tử :
- Xác định số electron của nguyên tử.
- Các electron được phân bố theo thứ tự tăng dần các mức năng lượng AO, theo các nguyên lí và quy tăc phân bố electron trong nguyên tử.
- Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
Thì dụ :
Na(Z=11) có 11 electron. Cấu hình electron của Na như sau : 1s22s22p63s1
Fe(Z=26) có 26 electron. Do có sự chèn mức năng lượng, các electron được phân bố như sau : 1s22s22p63s23p64s23d6
Sau đó phải sắp xếp các phân lớp theo từng lớp : 1s22s22p63s23p63d64s2
Hoặc viết gọn là : [Ar]3d64s2
[Ar] là kí hiệu cấu hình electron nguyên tử của nguyên tố agon, là khí hiếm gần nhất đứng trước Fe.
2. Cấu hình electron nguyên tử của một số nguyên tố
Dựa vào các nguyên lí và quy tắc nêu ở trên ta có thể xây dựng cấu hình electron nguyên tử của các nguyên tố khác. Dưới đây là cấu hình electron nguyên tử của 20 nguyên tố đầu tiên trong bảng tuần hoàn.
Cấu hình electron nguyên tử của 20 nguyên tố đầu tiên trong bảng tuần hoàn
3. Đặc điểm của lớp electron ngoài cùng
Các electron ở lớp ngoài cùng quyết định tính chất hoá học của một nguyên tố.
a) Đối với nguyên tử của các nguyên tố, số electron lớp ngoài cùng tối đa là 8. Các nguyên tử có 8 electron lớp ngoài cùng đều rất bền vững, chúng hầu như không tham gia vào các phản ứng hoá học. Đó là các nguyên tử khí hiếm ( trừ He có số electron lớp ngoài cùng là 2)
b) Các nguyên tử có 1,2,3 electron ở lớp ngoài cùng là các nguyên tử kim loại ( trừ H, He và B)
c) Các nguyên tử có 5,6,7 electron ở lớp ngoài cùng là các nguyên tử phi kim.
d) Các nguyên tử có 4 electron ớ lớp ngoài cùng có thể là nguyên tử kim loại hay phi kim.
