ong noi loc
New member
- Xu
- 26
Bài học dưới đây sẽ giúp các bạn tìm hiểu về một số hợp chất quan trọng của kim loại kiềm cũng như ứng dụng chúng.

BÀI 26 : KIM LOẠI KIỀM THỔ , HỢP CHẤT QUAN TRỌNG CỦA CHÚNG.

BÀI 26 : KIM LOẠI KIỀM THỔ , HỢP CHẤT QUAN TRỌNG CỦA CHÚNG.
B (II). HỢP CHẤT QUAN TRỌNG.
I- MỘT SỐ HỢP CHẤT CỦA CANXI
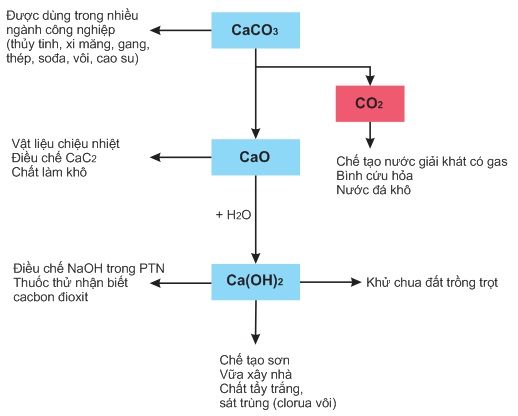
Hợp chất kim loại kiềm thổ phổ biến nhất và có ứng dụng rộng rãi hơn cả là hợp chất của canxi.
1. Canxi hiđroxit, Ca(OH)2

Canxi hiđroxit là chất rắn màu trắng, ít tan trong nước (độ tan ở 250C là 0,12g/100gH2O).
Dung dịch canxi hiđroxit (nước vôi trong) là một bazơ mạnh:
Ca(OH)[SUB]2[/SUB] ---------> Ca[SUP]2+[/SUP] + 2OH[SUP]−[/SUP]
Dung dịch canxi hiđroxit có những tính chất chung của một bazơ tan (tác dụng với oxit axit, axit, muối).
Chế tạo vữa xây nhà. Khử chua đất trồng trọt. Chế tạo clorua vôi dùng để tẩy trắng và khử trùng.
2. Canxi cacbonat, CaCO3

Canxi cacbonat là chất rắn màu trắng, không tan trong nước (độ tan ở 250C là 0,000013g/100gH2O)
Canxi cacbonat là muối của axit yếu và không bền, nên tác dụng được với nhiều axit hữu cơ và vô cơ giải phóng khí canbon đioxit
CaCO3 + 2HCl -----------> CaCl2 + H2O + CO2↑
CaCO3 + 2CH3 ------------> Ca(CH3COO)[SUB]2[/SUB] + H2O + CO2↑
Canxi cacbonat tan dần trong nước có chứa khí cacbon đioxit, tạo ra muối tan là canxi hiđrocacbonat Ca(HCO[SUB]3[/SUB])[SUB]2[/SUB]: CaCO3 + 2CH3 ------------> Ca(CH3COO)[SUB]2[/SUB] + H2O + CO2↑
CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2.
Phản ứng thuận giải thích sựu xâm thực của nước mưa (có chứa CO2) đối với đá vôi. Phản ứng nghịch giải thích sự tạo thành thạch nhũ trong các hang động núi đá vôi (hình dưới), sự tạo thành lớp canxi cacbonat (CaCO3) trong ấm đun nước, phích đựng nước nóng,...
b) Ứng dụng
3. Canxi sunfat, CaSO4
 a) Tính chất
a) Tính chất
Canxi sunfat là chất rắn, màu trắng, tan ít trong nước (độ tan ở 250C là 0,15g/100gH2O).
Tùy theo lượng nước kết tinh trong muối canxi sunfat, ta có ba loại:
CaSO4.2H2O có trong tự nhiên là thạch cao sống, bền ở nhiệt độ thường.
CaSO4.H2O hoặc CaSO4.0,5H2O là thạch cao nung, được điều chế bằng cách nung thạch cao sống ở nhiệt độ khoảng 1600C:
b) Ứng dụng
Thạch cao nung có thể kết hợp với nước tạo thành thạch cao sống và khi đông cứng thì dãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương,...
Thạch cao sống dùng để sản xuất xi măng.
II- NƯỚC CỨNG
1. Nước cứng
Nước có vai trò cực kì quan trọng đối với đời sống con người và hầu hết các ngành sản xuất, chăn nuôi, trồng trọt. Nước thường dùng là nước tự nhiên, được lấy từ dòng sông, suối, hồ, nước ngầm. Nước này có hòa tan một số muối, như
2. Phân loại nước
Căn cứ vào thành phần của anion gốc axit trong nước cứng, người ta phân thành 3 loại: Nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần.
a) Tính cứng tạm thời có nước cứng là do các muối Ca(HCO3)2,Mg(HCO3)2 gây ra:
c) Nước có tính cứng toàn phần là nước cứng tạm thời và vĩnh cửu.
3. Tác hại của nước
Thí nghiệm: Cho 2−3cm3 dung dịch Ca(HCO3)2 vào ống nghiệm. Thêm vào ống nghiệm một ít xà phòng hoặc vài giọt dung dịch xà phòng. Lắc mạnh ống nghiệm. Rút ra nhận xét.
Cho 2−3cm3 nước cất vào ống nghiệm rồi làm thí nghiệm như trên. Rút ra nhận xét và so sánh. Nước cứng gây nhiều trở ngại cho đời sống thường ngày. Giặt bằng xà phòng (natri stearat C17H35COONa ) trong nước cứng sẽ tạo ra muối không tan là canxi stearat (C[SUB]17[/SUB]H[SUB]35[/SUB]COO)[SUB]2[/SUB]Ca , chất này bám trên vải sợi, làm cho quần áo mau mục nát. Mặt khác, nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa của nó. Nếu dùng nước cứng để nấu thức ăn, sẽ làm cho thực phẩm lâu chín và giảm mùi vị.
Nước cứng cũng gây tác hại cho ngành sản xuất, như tạo ra các cặn trong nồi hơi, gây lãng phí nhiên liệu và không an toàn. Nước cứng gây ra hiện tượng làm tắc ống dẫn nước nóng trong sản xuất và trong đời sống. Nước cứng cũng làm hỏng nhiều dung dịch cần pha chế.
Vì vậy, việc làm mềm nước cứng trước khi dùng có ý nghĩa rất quan trọng.
4. Các biện pháp làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là giảm nồng độ các cation Ca[SUP]2+[/SUP],Mg[SUP]2+ [/SUP]trong nước cứng. Thực hiện nguyên tắc này, người ta dùng phương pháp chuyển những cation tự do này và hợp chất không tan (phương pháp kết tủa) hoặc thay thế những cation khác (phương pháp trao đổi ion).
a) Phương pháp kết tủa
Đối với nước có tính cứng tạm thời
Đun sôi nước có tính cứng tạm thời trước khi dùng, muối hiđrocacbonat chuyển thành cacbonat không tan:
Dùng một khối lượng vừa đủ dung dịch Ca(OH)2 để trung hòa muối hiđrocacbonat thành muối cacbonat kết tủa. Lọc bỏ chất không tan, được mức mềm:
Dùng dung dịch Na2CO3,Ca(OH)2 và dung dịch Na2PO4 để làm mềm nước cứng:
b) Phương pháp trao đổi ion
Phương pháp trao đổi ion được dùng phổ biến để làm mềm nước. Phương pháp này dựa trên khả năng trao đổi ion của các hạt zeolit (các alumino silicat kết tinh, có trong tự nhiên hoặc được tổng hợp, trong tinh thể có chứa những lỗ trống nhỏ) hoặc nhựa trao đổi ion. Thí dụ: cho nước cứng đi qua chất trao đổi ion là các hạt zeolit thì một số ion Na[SUP]+[/SUP] của zeolit thì một số ion Na[SUP]+[/SUP] của zeolit rời khỏi mạng tinh thể, đi vào trong nước nhường chỗ cho các ion Ca[SUP]2+[/SUP] và Mg[SUP]2+ [/SUP]bị giữ lại trong mạng tinh thể silicat.
Bài tập .
Hãy trả lời một số câu hỏi sau :
1/ Vì sao các hố nước vôi lâu ngày lại có màng kết tủa rắn màu trắng bên trên?
2/ Giai thích quá trình hình thành thạch nhủ trong hang động.
3/ Để làm mềm nước cứng có chứa các ion Cl- , Mg2+, Ca2+ . Có thể dùng một trong các dd sau ?
a. NaOH dư
b. Ca(OH)2 dư
c. Na3PO4
d. NaHCO3.
4/ Loại thạch cao nào được ứng dụng để bó xương , tạt tượng? Cho biết cách điều chế ?
5/ Tính khối lượng dd nước vôi trong sau khi dẫn vào đó 0,15mol CO2 biết số mol dd vôi trong ban đầu là 0,01mol?

Canxi sunfat là chất rắn, màu trắng, tan ít trong nước (độ tan ở 250C là 0,15g/100gH2O).
Tùy theo lượng nước kết tinh trong muối canxi sunfat, ta có ba loại:
CaSO4.2H2O có trong tự nhiên là thạch cao sống, bền ở nhiệt độ thường.
CaSO4.H2O hoặc CaSO4.0,5H2O là thạch cao nung, được điều chế bằng cách nung thạch cao sống ở nhiệt độ khoảng 1600C:
CaSO4.2H2O -------1600[SUP]o[/SUP]C------> CaSO4.H2O + H2O
CaSO4 có tên là thạch cao khan, được điều chế bằng cách nung thạch cao sống ở nhiệt độ cao hơn. Thạch cao khan không tan và không tác dụng với nước.
b) Ứng dụng
Thạch cao nung có thể kết hợp với nước tạo thành thạch cao sống và khi đông cứng thì dãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương,...
Thạch cao sống dùng để sản xuất xi măng.
II- NƯỚC CỨNG
1. Nước cứng
Nước có vai trò cực kì quan trọng đối với đời sống con người và hầu hết các ngành sản xuất, chăn nuôi, trồng trọt. Nước thường dùng là nước tự nhiên, được lấy từ dòng sông, suối, hồ, nước ngầm. Nước này có hòa tan một số muối, như
Ca(HCO3)2,Mg(HCO3)2,CaSO4,MgSO4,CaCl2,MgCl2. Vì vậy nước, trong tự nhiên có các cation Ca[SUP]2+[/SUP],Mg[SUP]2+[/SUP]. Nước cứng là nước có chứa nhiều cation Ca[SUP]2[/SUP]+,Mg[SUP]2+ [/SUP]. Nước chứa ít hoặc không chứa các ion trên được gọi là nước mềm.
2. Phân loại nước
Căn cứ vào thành phần của anion gốc axit trong nước cứng, người ta phân thành 3 loại: Nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần.
a) Tính cứng tạm thời có nước cứng là do các muối Ca(HCO3)2,Mg(HCO3)2 gây ra:
Ca(HCO[SUB]3[/SUB])[SUB]2[/SUB] ----------> Ca[SUP]2+[/SUP] + 2HCO[SUB]3[/SUB][SUP]-[/SUP]
Mg(HCO[SUB]3[/SUB])[SUB]2[/SUB] ----------> Mg[SUP]2+[/SUP] +2HCO[SUB]3[/SUB][SUP]-[/SUP]
b) Tính cứng vĩnh cửu của nước cứng là do các muối CaCl2,MgCl2,CaSO4,MgSO4 gây ra:Mg(HCO[SUB]3[/SUB])[SUB]2[/SUB] ----------> Mg[SUP]2+[/SUP] +2HCO[SUB]3[/SUB][SUP]-[/SUP]
CaCl2 ----------->Ca[SUP]2+ [/SUP]+ 2Cl−
MgCl2 ----------->Mg[SUP]2+[/SUP] + 2Cl−
CaSO4 ----------> Ca[SUP]2+[/SUP] + SO[SUB]4[/SUB][SUP]2-[/SUP]
MgSO4 ---------->Mg[SUP]2+ [/SUP] + SO[SUB]4[/SUB][SUP]2-[/SUP]
Nước tự nhiên thường có tính cứng tạm thời và vĩnh cửu.MgCl2 ----------->Mg[SUP]2+[/SUP] + 2Cl−
CaSO4 ----------> Ca[SUP]2+[/SUP] + SO[SUB]4[/SUB][SUP]2-[/SUP]
MgSO4 ---------->Mg[SUP]2+ [/SUP] + SO[SUB]4[/SUB][SUP]2-[/SUP]
c) Nước có tính cứng toàn phần là nước cứng tạm thời và vĩnh cửu.
3. Tác hại của nước
Thí nghiệm: Cho 2−3cm3 dung dịch Ca(HCO3)2 vào ống nghiệm. Thêm vào ống nghiệm một ít xà phòng hoặc vài giọt dung dịch xà phòng. Lắc mạnh ống nghiệm. Rút ra nhận xét.
Cho 2−3cm3 nước cất vào ống nghiệm rồi làm thí nghiệm như trên. Rút ra nhận xét và so sánh. Nước cứng gây nhiều trở ngại cho đời sống thường ngày. Giặt bằng xà phòng (natri stearat C17H35COONa ) trong nước cứng sẽ tạo ra muối không tan là canxi stearat (C[SUB]17[/SUB]H[SUB]35[/SUB]COO)[SUB]2[/SUB]Ca , chất này bám trên vải sợi, làm cho quần áo mau mục nát. Mặt khác, nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa của nó. Nếu dùng nước cứng để nấu thức ăn, sẽ làm cho thực phẩm lâu chín và giảm mùi vị.
Nước cứng cũng gây tác hại cho ngành sản xuất, như tạo ra các cặn trong nồi hơi, gây lãng phí nhiên liệu và không an toàn. Nước cứng gây ra hiện tượng làm tắc ống dẫn nước nóng trong sản xuất và trong đời sống. Nước cứng cũng làm hỏng nhiều dung dịch cần pha chế.
Vì vậy, việc làm mềm nước cứng trước khi dùng có ý nghĩa rất quan trọng.
Một mẫu chất rắn do sự kết tủa từ nước cứng.


4. Các biện pháp làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là giảm nồng độ các cation Ca[SUP]2+[/SUP],Mg[SUP]2+ [/SUP]trong nước cứng. Thực hiện nguyên tắc này, người ta dùng phương pháp chuyển những cation tự do này và hợp chất không tan (phương pháp kết tủa) hoặc thay thế những cation khác (phương pháp trao đổi ion).
a) Phương pháp kết tủa
Đối với nước có tính cứng tạm thời
Đun sôi nước có tính cứng tạm thời trước khi dùng, muối hiđrocacbonat chuyển thành cacbonat không tan:
Ca(HCO[SUB]3[/SUB])[SUB]2 ------------->[/SUB]CaCO3↓ + CO2↑ + H2O
Mg(HCO[SUB]3[/SUB])[SUB]2 -------------->[/SUB]MgCO3↓ + CO2↑ + H2O
Lọc bỏ kết tủa, được nước mềm.Mg(HCO[SUB]3[/SUB])[SUB]2 -------------->[/SUB]MgCO3↓ + CO2↑ + H2O
Dùng một khối lượng vừa đủ dung dịch Ca(OH)2 để trung hòa muối hiđrocacbonat thành muối cacbonat kết tủa. Lọc bỏ chất không tan, được mức mềm:
Ca(HCO3)2 + Ca(OH)2 ---------> 2CaCO3↓ + 2H2O
Đối với nước có tính cứng vĩnh cửu
Dùng dung dịch Na2CO3,Ca(OH)2 và dung dịch Na2PO4 để làm mềm nước cứng:
Ca[SUP]2+[/SUP] + CO[SUB]3[/SUB][SUP]2−[/SUP] → CaCO3↓
3Ca[SUP]2+[/SUP] + 2PO[SUB]4[/SUB][SUP]3−[/SUP] → Ca[SUB]3[/SUB](PO[SUB]4[/SUB])[SUB]2[/SUB]↓
Mg[SUP]2+[/SUP] + Ca(OH)[SUB]2[/SUB] → Mg(OH)[SUB]2[/SUB]↓ + 2Na[SUP]+[/SUP]
Dung dịch Na2CO3 cũng được dùng để làm mềm nước có tính cứng tạm thời.3Ca[SUP]2+[/SUP] + 2PO[SUB]4[/SUB][SUP]3−[/SUP] → Ca[SUB]3[/SUB](PO[SUB]4[/SUB])[SUB]2[/SUB]↓
Mg[SUP]2+[/SUP] + Ca(OH)[SUB]2[/SUB] → Mg(OH)[SUB]2[/SUB]↓ + 2Na[SUP]+[/SUP]
b) Phương pháp trao đổi ion
Phương pháp trao đổi ion được dùng phổ biến để làm mềm nước. Phương pháp này dựa trên khả năng trao đổi ion của các hạt zeolit (các alumino silicat kết tinh, có trong tự nhiên hoặc được tổng hợp, trong tinh thể có chứa những lỗ trống nhỏ) hoặc nhựa trao đổi ion. Thí dụ: cho nước cứng đi qua chất trao đổi ion là các hạt zeolit thì một số ion Na[SUP]+[/SUP] của zeolit thì một số ion Na[SUP]+[/SUP] của zeolit rời khỏi mạng tinh thể, đi vào trong nước nhường chỗ cho các ion Ca[SUP]2+[/SUP] và Mg[SUP]2+ [/SUP]bị giữ lại trong mạng tinh thể silicat.
Bài tập .
Hãy trả lời một số câu hỏi sau :
1/ Vì sao các hố nước vôi lâu ngày lại có màng kết tủa rắn màu trắng bên trên?
2/ Giai thích quá trình hình thành thạch nhủ trong hang động.
3/ Để làm mềm nước cứng có chứa các ion Cl- , Mg2+, Ca2+ . Có thể dùng một trong các dd sau ?
a. NaOH dư
b. Ca(OH)2 dư
c. Na3PO4
d. NaHCO3.
4/ Loại thạch cao nào được ứng dụng để bó xương , tạt tượng? Cho biết cách điều chế ?
5/ Tính khối lượng dd nước vôi trong sau khi dẫn vào đó 0,15mol CO2 biết số mol dd vôi trong ban đầu là 0,01mol?
xem bài tiếp theo : https://diendankienthuc.net/diendan...-26-nhom-va-hop-chat-cua-nhom.html#post202665
Sửa lần cuối bởi điều hành viên:
