Spider_man
New member
- Xu
- 0
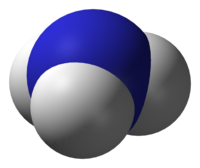
I. Công thức cấu tạo:
- Trong nguyên tử N, các đám mây electron ở lớp ngòai cùng lai hóa thành 4 đám mây \[s{p^3}\\]
- Ba obitan lai hóa \[s{p^3}\\], trên mỗi một obitan lai hóa N có 1 e độc thân, xen phủ với 3 obitan 1s có 1 e độc thân của nguyên tử hidro tạo 3 liên kết N – H.
II. Tính chất lý hóa:
- Là chất khí không màu, mùi khai và xốc, tan trong nước( NH3 lai hóa sp3, phân tử hình tháp phân cực. Do phân tử phân cực và NH2 tạo được liên kết hidro với H2O nên NH3 tan nhiều trong nước ).
III. Tính chất hóa học:
1. Tính bazơ yếu:
Trên nguyên tử nitơ của amoniac có cặp electron tự do nên amoniac có tính bazơ và có thể xảy ra phản ứng hóa học:
\[N{H_3} + {H_2}O_ \leftarrow ^ \to NH_4^ + + O{H^ - }\\]
\[{K_b} = 1,{8.10^{ - 5}}\\]
Do đó \[N{H_3}\\] làm xanh giấy quỳ tím ẩm
\[N{H_3} + {H^ + } \to NH_4^ + \\]
\[A{l^{3 + }} + 3N{H_3} + 3{H_2}O \to Al{(OH)_3} \downarrow + 3NH_4^ + \\]
2. Khả năng tạo phức:
\[Cu{(OH)_2} + 4N{H_3} \to {\rm{[}}Cu{(N{H_3})_4}{\rm{](OH}}{{\rm{)}}_2}\\]
\[AgCl + 2N{H_3} \to {\rm{[}}Ag{(N{H_3})_2}{\rm{]}}Cl\\]
3. Tính khử:
Trong amoniac, nitơ có số oxi hóa thấp nhất nên amoniac có tính khử. Ví dụ như trong phản ứng hóa học:
\[4N{H_3} + 3{O_2} \to 2{N_2} + 6{H_2}O\\]
\[4N{H_3} + 5{O_2}_ \to ^{{{850}^o}C,Pt}4NO + 6{H_2}O\\]
\[2N{H_3} + 3C{l_2} \to {N_2} + 6HCl\\]
(sản phẩm sinh ra khói trắng là do khí HCl vừa tạo thành hóa hợp với \[N{H_3}\\])
\[3CuO + 2N{H_3}_ \to ^{{t^o}}3Cu + {N_2} + 3{H_2}O\\]
Thêm nữa, amoniac tương đối kém bền bởi nhiệt. Nó có thể bị phân hủy tại nhiệt độ cao theo phản ứng hóa học:
2NH[SUB]3[/SUB] → N[SUB]2[/SUB] + 3H[SUB]2[/SUB]
4. Phản ứng kết hợp:
\[N{H_3} + {H_2}O_ \leftarrow ^ \to NH_4^ + + O{H^ - }\\]
\[N{H_3} + HN{O_3} \to N{H_4}N{O_3}\\]
\[N{H_3} + HCl \to N{H_4}Cl\\]
5. Phản ứng điều chế:
- \[N{H_4}HC{O_3}\\]:
\[N{H_3} + C{O_2} + {H_2}O \to N{H_4}HC{O_3}\\]
- Ure:
\[2N{H_3} + C{O_2} \to {H_2}N - COON{H_4}\\]
\[{H_2}N - COON{H_4}_ \to ^{ - {H_2}O}{(N{H_2})_2}CO\\]
6. Phản ứng thế:
\[Na + N{H_3}_ \to ^{{t^o}}NaN{H_2} + \frac{1}{2}{H_2}\\]
\[Na + N{H_3}_ \to ^{{t^o}}N{a_2}N{H_2} + {H_2}\\]
\[Na + N{H_3}_ \to ^{{t^o}}N{a_3}N + \frac{3}{2}{H_2}\\]
\[2Al + 2N{H_3}_ \to ^{{t^o}}2AlN + 3{H_2}\\]
IV. Điều chế:
1. Trong phòng thí nghiệm:
\[2N{H_4}Cl + Ca{(OH)_2} \to 2N{H_3} \uparrow + CaC{l_2} + 2{H_2}O\\]
\[C{a_3}{N_2} + 6{H_2}O \to 3Ca{(OH)_2} + 2N{H_3} \uparrow \\]
2. Trong công nghiệp:
Phần lớn NH[SUB]3[/SUB] (90%) được sản xuất theo phương thức Haber-Bosch với N[SUB]2[/SUB] từ không khí, H[SUB]2[/SUB] từ khí Mêtan (CH[SUB]4[/SUB]) và nước.
\[{CH_4} + {H_2}O \to CO + 3{H_2}\]
\[{N_2}+3{H_2}_{_\leftarrow^\to}^{Fe,{t^o}C}2N{H_3}\\]
* Phương thức Persek từ nitrua nhôm AlN và nước
\[ 2AlN + 3{H_2}O \to {Al_2}{O_3} + 2{NH_3}\]
* Từ NO và H[SUB]2[/SUB]
\[2NO + 5{H_2} \to 2{NH_3} + 2{H_2}O \]
Nguồn: diendankienthuc.net
